Stéreochimie
| الموقع: | Campus Virtuel - Université de Jijel |
| المقرر: | Synthése Asymétrique |
| كتاب: | Stéreochimie |
| طبع بواسطة: | Visiteur anonyme |
| التاريخ: | الأربعاء، 9 أبريل 2025، 7:38 AM |
1. Stéréochimie
Branche de la chimie qui
étudie la disposition spatiale des atomes dans les molécules et l'influence de
cette disposition sur les propriétés chimiques et physiques.
2. Isomères
Les isomères sont des molécules qui partagent la même formule brute, mais qui diffèrent dans l’arrangement des atomes et donc dans leurs formules développées ou condensées. Ces composés ont des propriétés physiques différentes et parfois même des propriétés chimiques et biologiques différentes.
3. Isomérie plane (ou isomérie constitutionnelle)
Il existe trois types : isomérie de chaine, isomérie de position, et isomérie de fonction.
3.1. Isomérie de chaine (ou de squelette)
L'isomérie de chaîne (ou de squelette) désigne les isomères qui diffèrent par leur chaine carbonée.
Exemple: C8H10
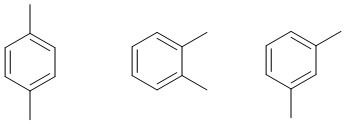
3.2. Isomérie de position
L'isomérie de position de fonction qualifie les isomères dont un groupe fonctionnel est placé sur des carbones différents de la chaîne carbonée, ce qui veut dire que c'est la fonction qui se déplace à l'intérieur du squelette.
Exemple: C4H7N
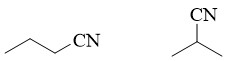
3.3. Isomérie de fonction
Les isomères appartiennent à des familles de composés chimiques différentes en raison de la présence de groupes fonctionnels différents. Deux isomères de fonction présentent des propriétés physiques et chimiques différentes.Exemple: C3H6O
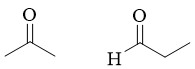
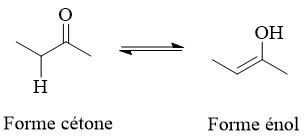
3.4. Isomérie de fonction avec groupes tautomères
Les isomères peuvent se transformer les uns
dans les autres par des déplacements d'atomes (souvent d'hydrogènes)
accompagnés du déplacement d'une double liaison. Un
exemple classique est l'équilibre céto-énolique.
4. Stéréoisomérie
La stéréoisomérie désigne les isomères de disposition dans l'espace, c'est-à-dire les molécules composées des mêmes types
et du même nombre d’atomes avec les mêmes liaisons, mais qui diffèrent dans
l’arrangement tridimensionnel des atomes (isomères de conformation et isomères
de configuration).
4.1. Isomères de conformation (conformères)
Ils diffèrent les uns des
autres par leur rotation autour d’une seule liaison. Les rotations se
produisent librement autour des liaisons simples carbone-carbone. Contrairement
aux liaisons doubles et triples, qui sont ‘verrouillées’ dans leur orientation,
les liaisons simples n’ont pas de telles restrictions. Ces isomères
représentent des formes différentes ou des orientations différentes de la même
molécule.
4.2. Atropisomères
Ils constituent un cas particulier des conformères. Ils résultent lorsqu’il y’a une rotation limitée autour d’une simple liaison, où la barrière d’énergie est assez élevée dues à une contrainte stérique ou à d’autres facteurs qui peut permettre l’isolement de conformères individuels.
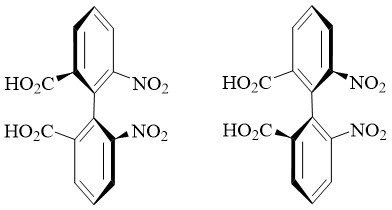
Atropisomères de l’acide
6,6'-dinitro-2,2'-diphénique
4.3. Isomères de configuration
Les stéréoisomères sont appelés isomères de configuration lorsque, pour passer de l’un de ces stéréoisomères à l’autre, des liaisons covalentes doivent être rompues et échangées, ce qui signifie qu’ils représentent des structures différentes et non pas la même molécule. Il y’a deux types: les isomères géométriques (cis et trans), et les isomères optiques.
Diastéréoisomère : Stéréoisomères avec deux centres chiraux ou plus et où les molécules ne sont pas des images miroir l’une de l’autre, par exemple, le D-érythrose et le D-thréose.
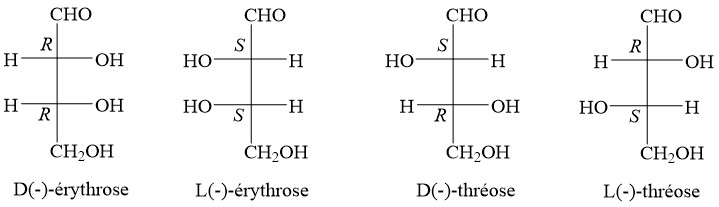
Épimères : Deux diastéréoisomères qui ne diffèrent entre eux que par la configuration d’un seul et unique carbone asymétrique. Ainsi, le L-Erythrose et le D-Thréose sont des épimères.
Énantiomère : Deux stéréoisomères qui sont des images miroir non superposables l’un de l’autre.
5. Nomenclature R/S
En suivant les règles de Cahn-Ingold-Prelog, nous pouvons attribuer la configuration absolue (R) et (S) des stéréocentres.
6. D/L et d/l
D ou L : Configurations absolues attribuées à une
molécule par le biais de corrélations avec la configuration du D- ou L-glycéraldéhyde;
souvent appliquées aux acides aminés et aux sucres.
Dans le cas des sucres, on s’intéresse au groupe -OH situé sur le dernier atome asymétrique.
Pour les aminoacides, on s’intéresse au groupe amino porté par le premier atome de carbone asymétrique. L’alanine naturelle appartient à la série L.
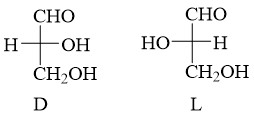
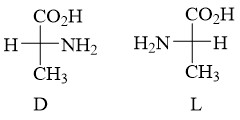
d ou l : Dextrogyre ou lévogyre, attribués en fonction de la propriété de dévier le plan de lumière monochromatique polarisée vers la droite (+) ou la gauche (-). Il n’y a aucun rapport entre le pouvoir rotatoire et les nomenclatures R/S et L/D.
7. Prochiralité
La prochiralité fait référence à l’existence de
ligands ou de faces hétérotopes dans une molécule qui, lorsque le ligand
est remplacé ou lorsqu’une addition est faite sur cette face on obtient des
produits chiraux.
7.1. Enantiotopique et distéréotopique
Les hydrogènes prochiraux peuvent être désignés comme étant soit énantiotopiques, soit diastéréotopiques. Si on prend l’éthanol comme exemple si l’un des hydrogènes de l’éthanol est remplacé par un groupement différent du méthyl, les deux isomères résultants seraient des énantiomères (car il n’y a pas d’autres stéréocentres sur la molécule).
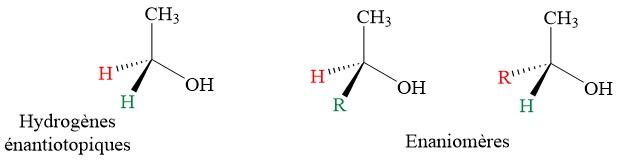
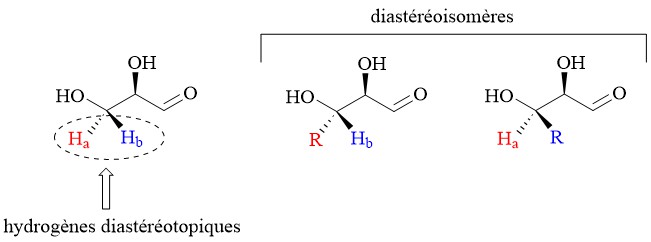
Pour le (R)-glyceraldehyde, les deux H sont diastéréotopiques.
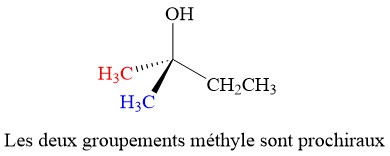
Les groupes autres que les hydrogènes peuvent être aussi considérés comme prochiraux. L’alcool ci-dessous possède deux groupes méthyle prochiraux.
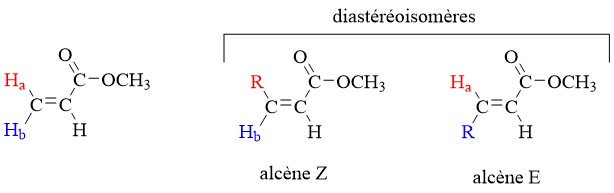
Bien qu’un atome de carbone d’un alcène lié à deux groupes identiques ne soit pas considéré comme un centre prochiral, ces deux groupes peuvent être diastéréotopiques. Par exemple, Ha et Hb sur l’alcène ci-dessous sont diastéréotopiques : si nous remplaçons l’un, puis l’autre, de ces hydrogènes par un autre groupement, les composés résultants sont des diastéréoisomères E et Z.
7.2. Homotopique
Les hydrogènes qui ne peuvent être désignés ni comme énantiotopiques ni comme diastéréotopiques sont appelés homotopiques. Si un hydrogène homotopique est remplacé par un groupement, un centre chiral n’est pas créé. Les trois atomes d’hydrogène sur le groupe méthyle (CH3) de l’éthanol sont homotopiques.
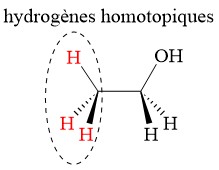
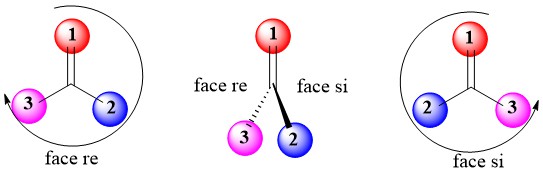
8. Faces re et si
Les carbones trigonaux planaires, hybridés en sp2, peuvent être des centres prochiraux s’ils sont liés à trois substituants différents. On peut distinguer entre les deux faces planes d’un groupe prochiral hybridé en sp2. Ces faces sont désignées par les termes re et si. Pour déterminer laquelle est la face re et laquelle est la face si, on utilise les mêmes classements de priorité du système R/S.
9. Mélange racémique
Un mélange racémique est un mélange équimolaire de deux énantiomères et est donc optiquement inactif.
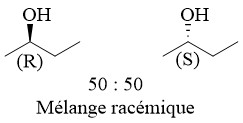
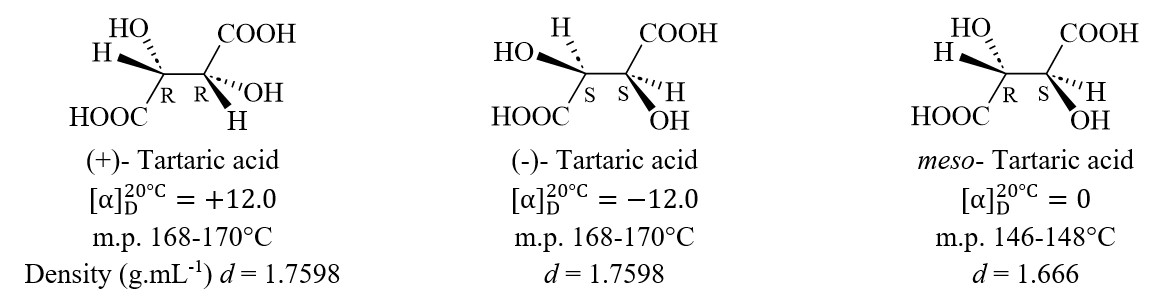
10. La forme méso
Deux centres stéréogènes identiquement substitués donnent naissance à seulement trois stéréoisomères. Prenons l’exemple de l’acide tartrique (acide 2,3-dihydroxybutanedioïque). La molécule possède deux centres de chiralité et pourrait donc avoir quatre stéréoisomères. Cependant, en raison de la présence d’un plan de symétrie, il n’y a que trois stéréoisomères. L’isomère méso est achiral.
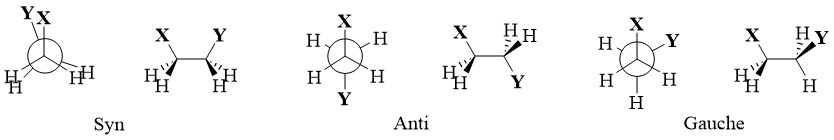
11. Anti, syn, et gauche
Anti: Terme utilisé
pour décrire deux substituants attachés à des atomes adjacents lorsque leurs
liaisons sont à 180 degrés l’une par rapport à l’autre. Il s’agit d’une
conformation décalée et est, dans la majorité des cas, la plus stable, car les
deux groupes sont aussi éloignés que possible.
Gauche: Terme utilisé pour décrire deux substituants attachés à des atomes adjacents lorsque leurs liaisons sont à 60 degrés l’une par rapport à l’autre. Il s’agit également d’une conformation décalée.
Syn: Terme utilisé pour décrire deux substituants attachés à des atomes adjacents lorsque leurs liaisons sont à 0 degrés l’une par rapport à l’autre. Il s’agit d'une conformation éclipsée et est la moins stable en raison de la contrainte stérique causée par la proximité des deux groupes et de la contrainte de torsion des liaisons éclipsées.
→ Les conformères anti, gauche et syn ont des énergies différentes en raison de la contrainte stérique, qui résulte de la répulsion entre les atomes ou les groupes proches les uns des autres. La contrainte de torsion est une déstabilisation due à la répulsion entre une paire de liaisons trop proches les unes des autres.
12. Stéréochimie dynamique
La stéréochimie dynamique traite des relations entre la réactivité et la stéréochimie. On va voir quelques exemples de réactions stéréosélectives et stéréospécifiques.
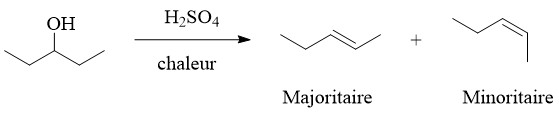
La réaction E1 est stéréosélective; lorsque des produits cis et trans sont possibles, on observe généralement une préférence pour la formation du stéréoisomère trans.
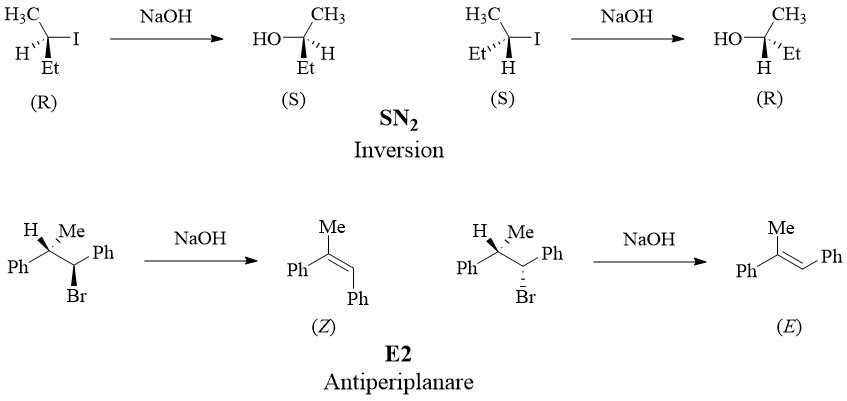
Les réactions stéréospécifiques, telles que SN2 et E2, signifient qu’un stéréoisomère donné d’un réactif produit un stéréoisomère donné du produit, tandis qu’un stéréoisomère du même réactif produit un stéréoisomère différent du même produit.
13. Résumé
